溶酶体的生物发生[细胞生物学]
发布时间:2011-10-18 共1页
溶酶体的生物发生
溶酶体的形成是一个相当复杂的过程, 涉及的细胞器有内质网、高尔基体和内体等。比较清楚的是甘露糖-6-磷酸途径(mannose 6-phosphate sorting pathway):溶酶体的酶类在内质网上起始合成, 跨膜进入内质网的腔, 在顺面高尔基体带上甘露糖6-磷酸标记后在高尔基体反面网络形成溶酶体分泌小泡, 最后还要通过脱磷酸才成为成熟的溶酶体(图9-44)。
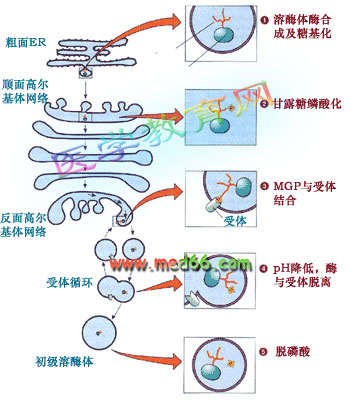
图9-44 溶酶体的酶寻靶过程、涉及的细胞器及机理
大多数溶酶体的酶在寡糖链上含有甘露糖, 在顺面高尔基网络转变成甘露糖-6-磷酸。新形成的溶酶体的酶通过高尔基复合体,在高尔基体反面网络与膜受体结合后被包进溶酶体分泌小泡,通过出芽形成自由的分泌泡。通过H+-质子泵调节溶酶体分泌小泡中的pH,使溶酶体的酶同受体脱离,受体再循环, 溶酶体酶脱磷酸后成为成熟的初级溶酶体。
■ 溶酶体酶蛋白的M6P标记
研究发现,溶酶体的酶上都有一个特殊的标记∶6-磷酸甘露糖(mannose 6-phosphate, M6P)。这一标记是溶酶体酶合成后在粗面内质网和高尔基体通过糖基化和磷酸化添加上去的。
● 糖基化
溶酶体酶蛋白在膜旁核糖体上合成,进入内质网后进行N-连接糖基化, 经加工后形成带有8个甘露糖残基和2个N-乙酰葡萄糖胺残基的糖蛋白转运到高尔基体。
● 信号斑(signal patch)
信号斑是溶酶体酶蛋白多肽形成的一个特殊的三维结构, 它是由三段信号序列构成的, 可被磷酸转移酶特异性识别(图9-45)。

图 9-45 信号斑
溶酶体蛋白的多肽上有三段信号序列, 通过折叠,三个信号序列相互靠近形成信号斑结构。
● 甘露糖磷酸化的酶
将磷酸基团添加到溶酶体酶的甘露糖的第六位碳上的反应是由两种酶催化的,一种酶是N-乙酰葡萄糖胺磷酸转移酶(N-acetyglucosamine phosphotransferase),另一个酶是N-乙酰葡萄糖苷酶, 功能是释放N-乙酰葡萄糖胺(46)。

图9-46 溶酶体酶蛋白信号斑与磷酸化酶相互作用
顺面高尔基体中的N-乙酰葡萄糖胺磷酸转移酶有两个功能位点,一个识别位点能够识别信号斑并与之结合;催化位点与高甘露糖N-连接的寡聚糖以及UDP-GlcNAc结合。
● 磷酸化反应
反应中磷酸基的供体是UDP N-乙酰葡萄糖胺(N-acetyglucosamine,GlcNAc), 甘露糖残基磷酸化的位点是第六位碳原子(图9-47)。每个溶酶体酶蛋白至少有一个甘露糖残基被磷酸化。

图9-47 溶酶体酶蛋白甘露糖残基磷酸化的生化反应
■ 溶酶体酶的M6P分选途径
这一途径的两个关键是:M6P标记和M6P受体蛋白。
● M6P受体蛋白(M6P receptor protein)
M6P受体蛋白是反面高尔基网络上的膜整合蛋白, 能够识别溶酶体水解酶上的M6P信号并与之结合, 从而将溶酶体的酶蛋白分选出来。
M6P受体蛋白主要存在于高尔基体的反面网络,但在一些动物细胞的质膜中发现有很多M6P受体蛋白的存在, 这是细胞的一种保护机制, 可防止溶酶体的酶不正确地分泌到细胞外。
● 分选过程

图9-48 综合了溶酶体酶的甘露糖6-磷酸分选途径和溶酶体形成的主要过程。
溶酶体酶前体从粗面内质网转移到顺面高尔基体, 并进行甘露糖残基的磷酸化。在反面高尔基网络,磷酸化的酶同M6P受体结合,通过该受体将溶酶体的酶包装到由纤维状网格蛋白包被的小泡中, 然后网格蛋白外被很快解体。无包被的运输小泡很快与次级内体融合, 由于次级内体中pH呈酸性, 致使磷酸化的酶与M6P受体脱离, 接着脱磷酸。通过次级内体的分选作用。 溶酶体的酶进入从次级内体出芽形成的运输小泡, 接着同溶酶体融合完成溶酶体酶的传递过程。而受体重新回到高尔基体再利用。为简化起见, 图中只标出酶蛋白的一个糖基化位点, 实际上大多数糖蛋白具有多个糖基化的位点。M6P受体也位于细胞质膜中, 它能够同偶尔分泌到细胞外磷酸化的溶酶体酶结合, 并形成由网格蛋白包被的运输泡, 最后同样被传递给溶酶体。
●影响M6P分选的因素
Brown 和Farquhar 发现用胺离子(NH4+)处理细胞能够干扰溶酶体的分选机制。当溶酶体中胺离子浓度升高时会使溶酶体中的pH升高, 这样, 溶酶体的酶就不能同M6P受体脱离, 从而影响了M6P受体回到高尔基体再循环。其结果,由于高尔基体反面网络中M6P受体的不足, 溶酶体的酶就会分泌到细胞外而不是被包装到溶酶体分泌小泡。如果解除NH4+的作用, 使M6P受体得以释放和再循环, 溶酶体的分选恢复正常。
●M6P分选途径的特点:
①M6P作为分选信号; ②包埋在高尔基体中的受体能够被网格蛋白包装成分泌小泡; ③出芽形成的溶酶体酶的运输小泡只同酸性的次级内体融合; ④通过次级内体的分选作用使受体再循环。
■ M6P分选途径的发现
M6P分选途径是通过对一类遗传病: 称为溶酶体贮积症(lysosomal storage diseases)的研究发现的,此类遗传病是由于溶酶体中缺少一种或几种酶所致。
■ 内体(endosome)
内体有初级内体(early endosome)和次级内体(late endosome)之分, 内体的主要特征是酸性的、不含溶酶体酶的小囊泡。初级内体是由于细胞的内吞作用而形成的含有内吞物质的膜结合的细胞器。
次级内体中的pH呈酸性, 且具有分拣作用。内体膜上具有ATPase-H+ 质子泵,利用H+ 质子的浓度,保证了内部pH的酸性(图9-49)。

图9-49 溶酶体酶运输小泡与次级内体的融合及次级内体的分选作用
■ 溶酶体形成的非M6P途径
M6P途径是溶酶体酶分选的主要途径,但不是惟一的途径, 这主要是通过对一种遗传病的研究发现的。
● 粘脂病(mucolipidosis)是一种遗传病,这种病人不能使甘露糖磷酸化。病人的成纤维细胞中含有很多细胞质小泡,小泡中有大量的未被消化的大分子, 这些大分子在正常情况下是由溶酶体降解的。由于甘露糖不被磷酸化,意味着大多数溶酶体酶不能正确地进入溶酶体。
● 非磷酸化的溶酶体酶
在粘脂病的病人细胞的溶酶体中发现有未被磷酸化的水解酶, 推测这些酶是通过非M6P依赖性的分选途径进入溶酶体的。这种推测从I-细胞病人的肝细胞溶酶体酶分析中得到证实。I-细胞病人的肝细胞中溶酶体的酶也没有M6P标记,但是能够进入溶酶体, 这就说明这些溶酶体必然是通过非M6P依赖的途径进入溶酶体的,但机理尚不清楚。
● 非M6P途径的可能方式
两种可能:一是作为膜蛋白,合成时就插在膜上;另一种可能就是作为前体合成并结合在膜上, 进入溶酶体膜后水解释放到溶酶体腔中。
请举例说明溶酶体酶进入溶酶体的非M6P途径的可能方式。
■ 溶酶体与疾病
已知有不少疾病与溶酶体有关, 如贮积症(storage diseases)、I-细胞病、矽肺、类风湿性关节炎等。
● 矽肺病(silicosis)
● Ⅱ型糖原贮积症(glycogen storage disease type Ⅱ)
● 休克(shock)

